Viết công thức electron, công thức cấu tạo của phân tử
VnHocTap.com giới thiệu đến các em học sinh lớp 10 bài viết Viết công thức electron, công thức cấu tạo của phân tử, nhằm giúp các em học tốt chương trình Hóa học 10.
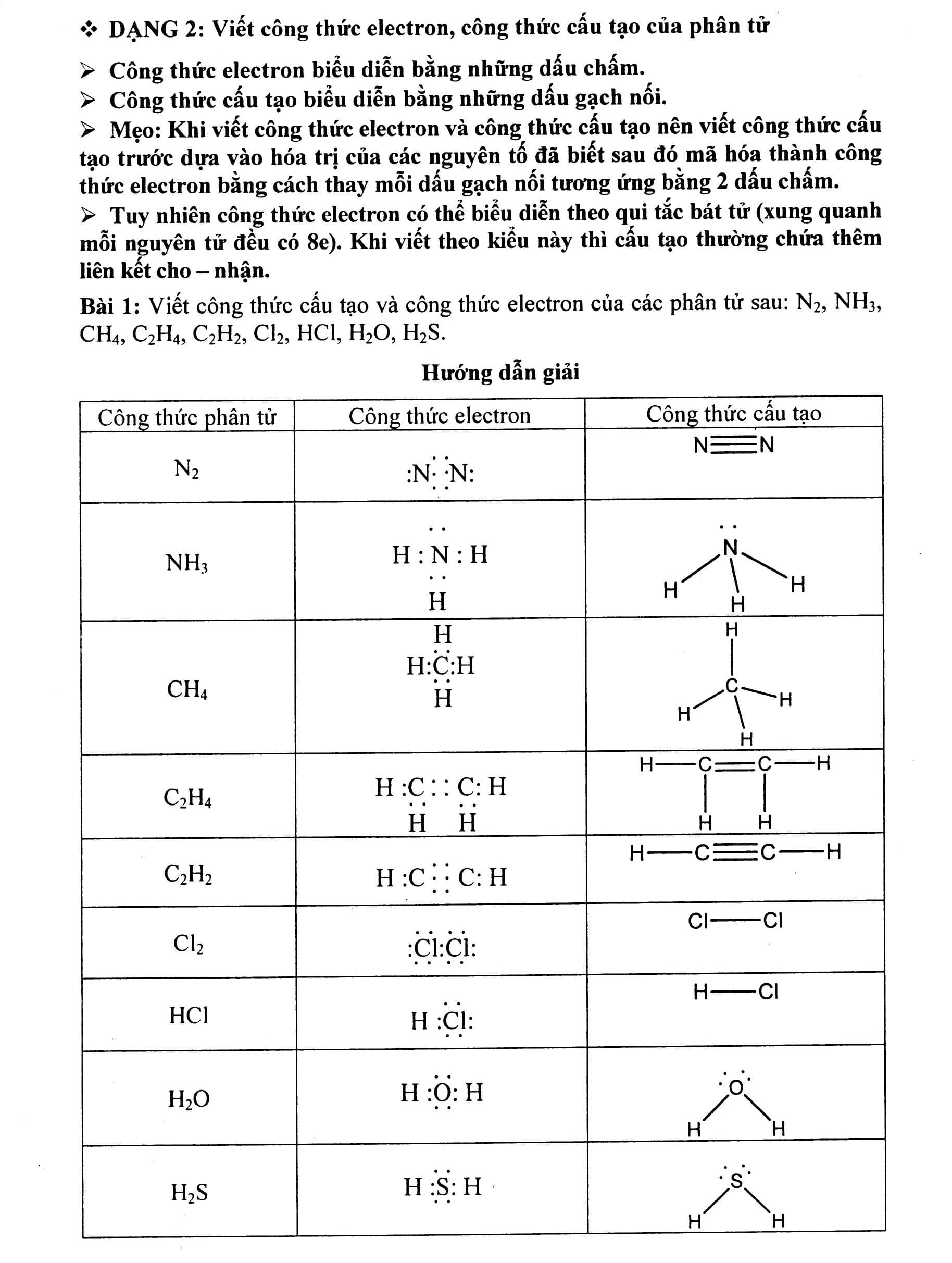

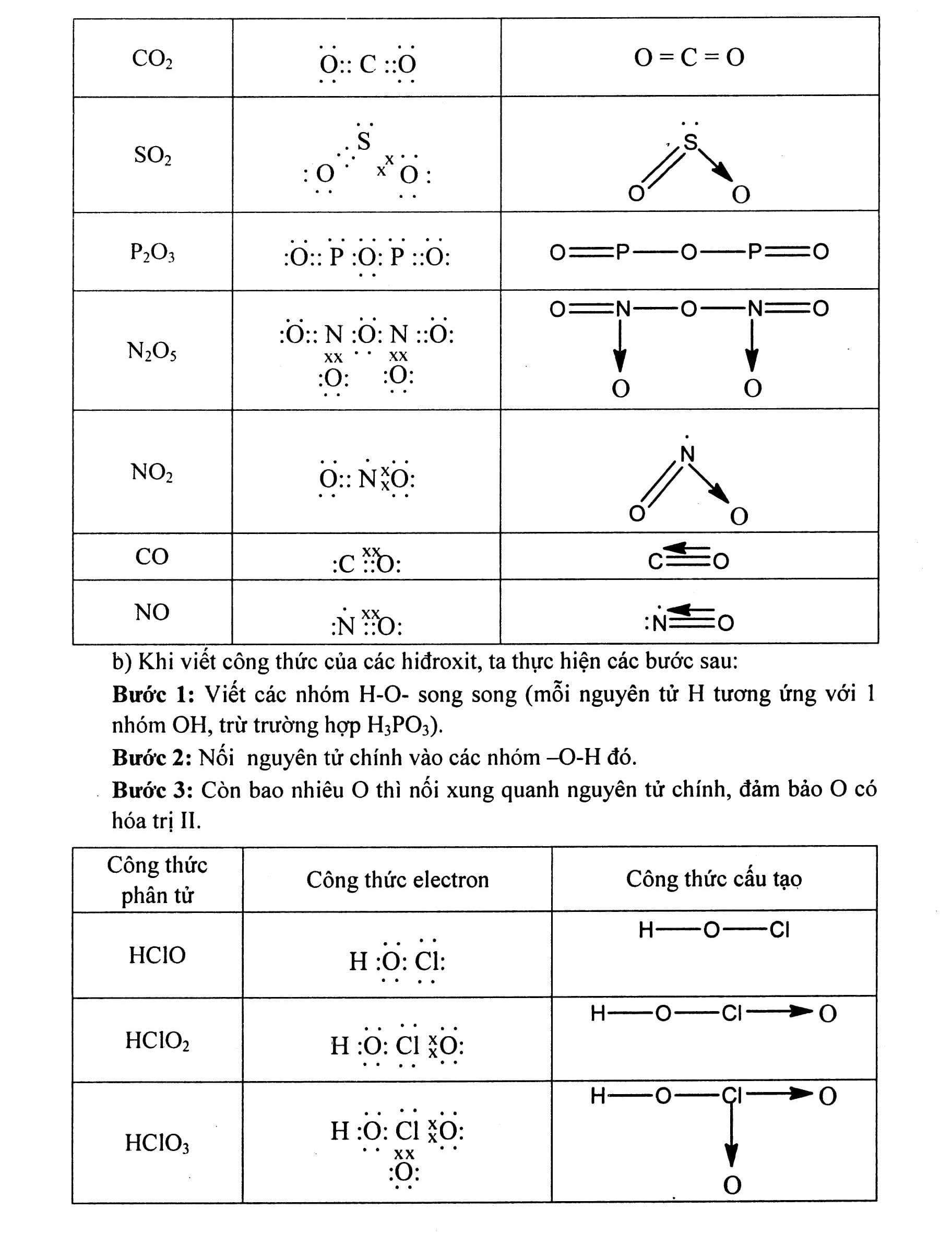
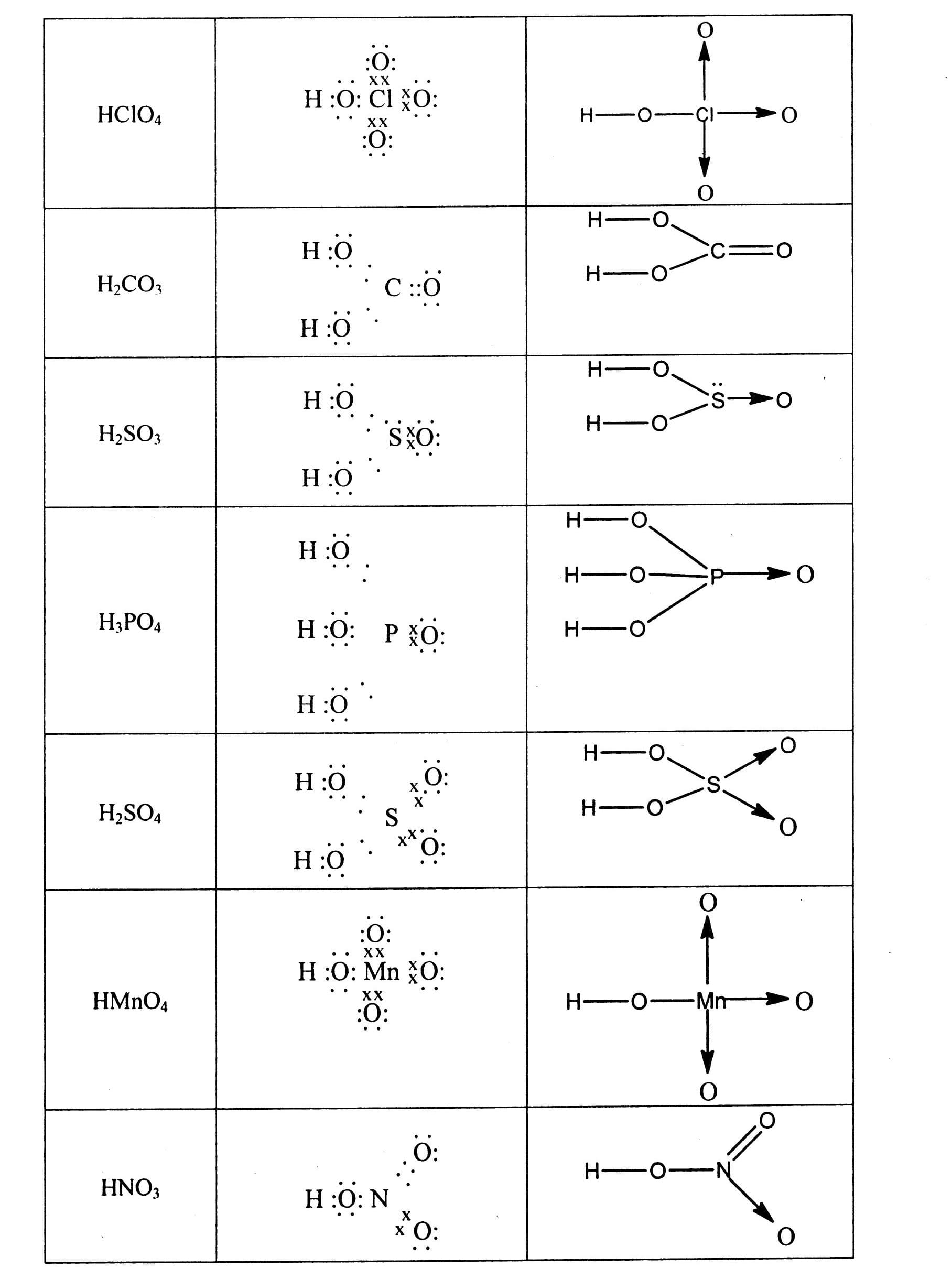
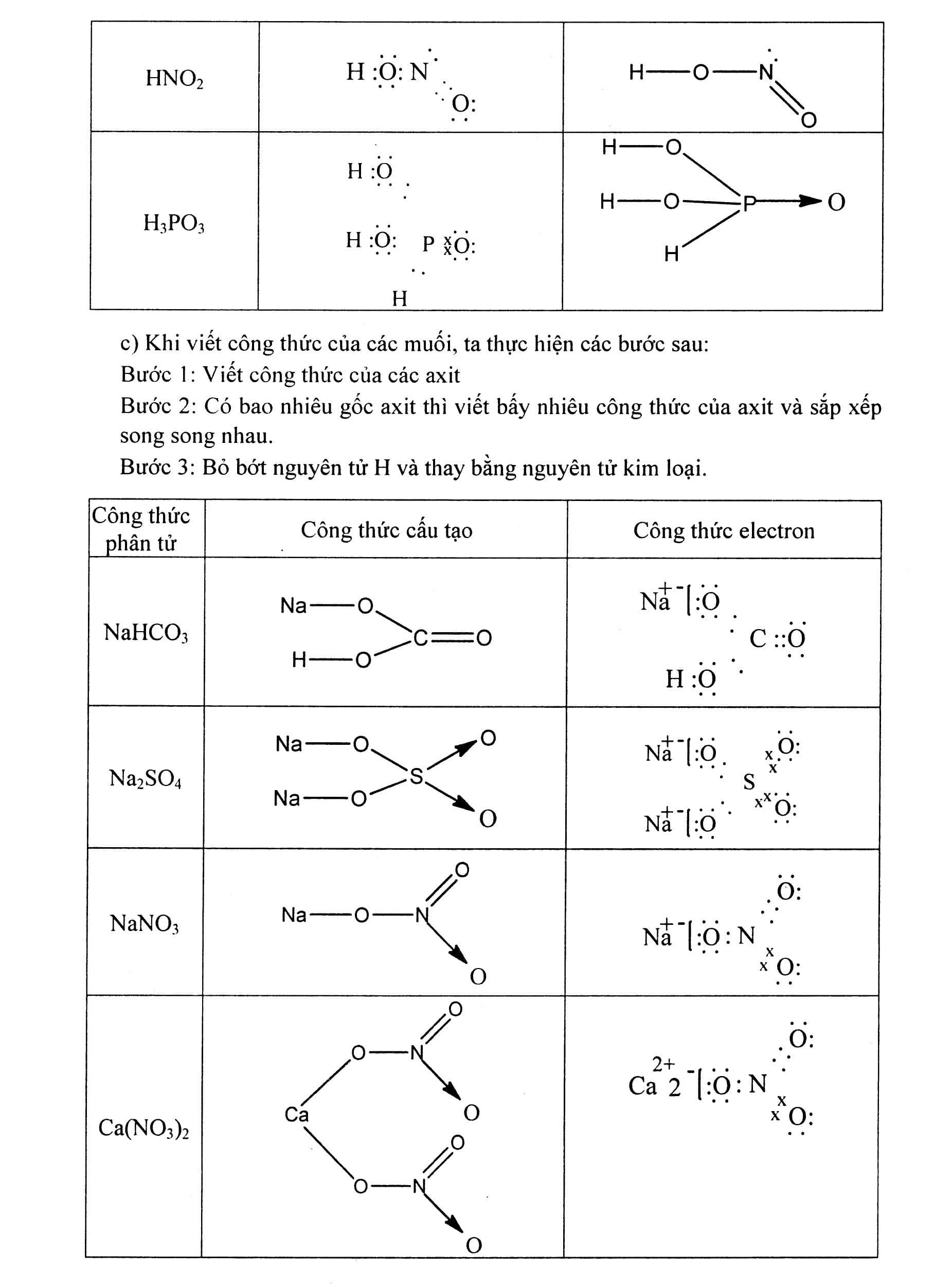

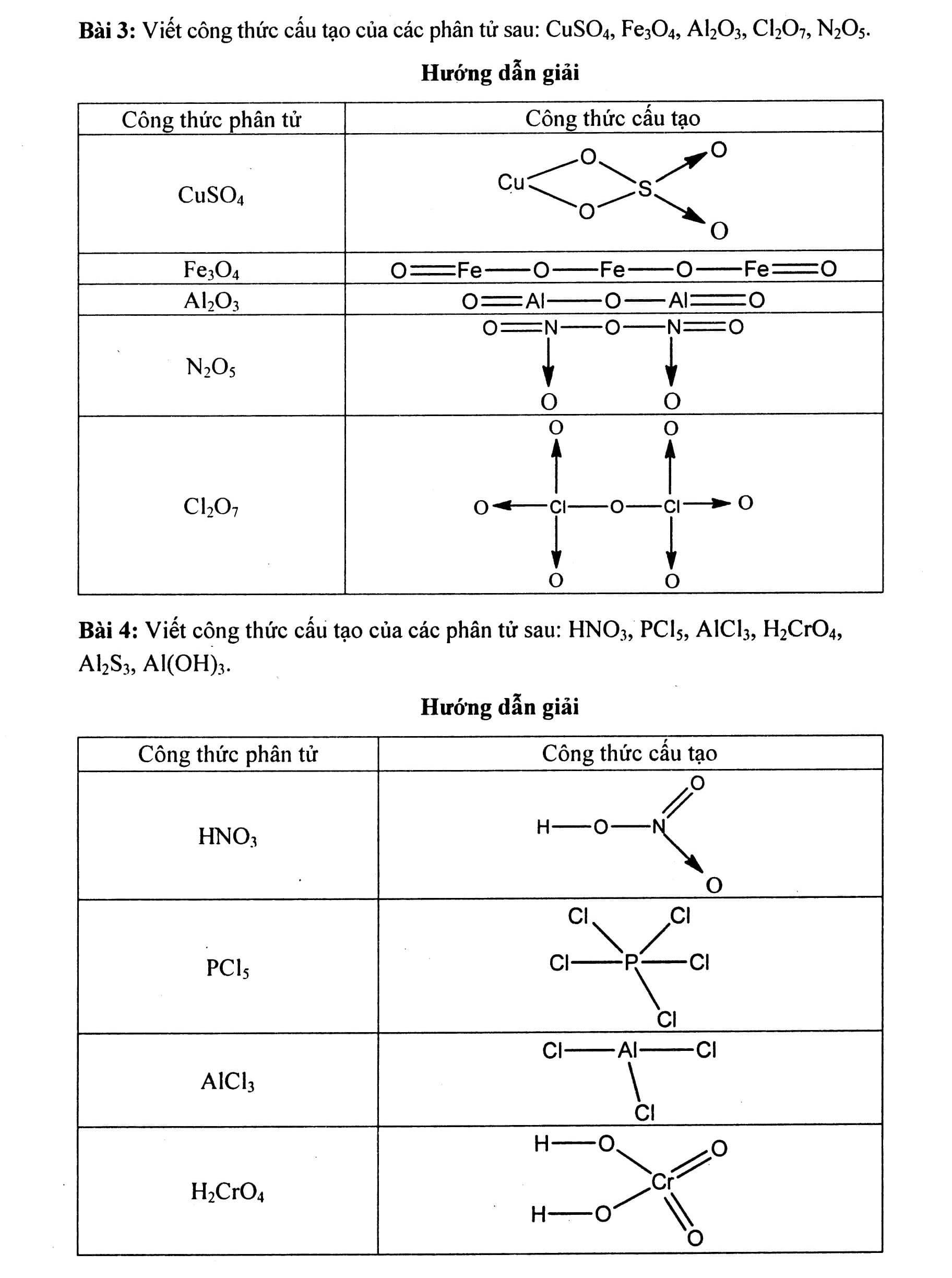


Nội dung bài viết Viết công thức electron, công thức cấu tạo của phân tử: Công thức electron biểu diễn bằng những dấu chấm. Công thức cấu tạo biểu diễn bằng những dấu gạch nối. Mẹo: Khi viết công thức electron và công thức cấu tạo nên viết công thức cấu tạo trước dựa vào hóa trị của các nguyên tố đã biết sau đó mã hóa thành công thức electron bằng cách thay mỗi dấu gạch nối tương ứng bằng 2 dấu chấm. Tuy nhiên công thức electron có thể biểu diễn theo qui tắc bát tử (xung quanh mỗi nguyên tử đều có 8e). Khi viết theo kiểu này thì cấu tạo thường chứa thêm liên kết cho – nhận. Bài 1: Viết công thức cấu tạo và công thức electron của các phân tử sau: N2, NH3, CH4, C2H4, C2H2, Cl2, HCl, H2O, H2S. Hướng dẫn giải Công thức phân tử Công thức electron Công thức cấu tạo. Bài 2: Viết công thức electron và công thức cấu tạo của các phân tử Hướng dẫn giải a) Khi viết công thức của các oxit dạng R2Ox, ta thực hiện các bước sau: Bước 1: Viết một nguyên tử O trước. Bước 2: Nối hai nguyên tử chính vào nguyên tử O đó. Bước 3: Còn bao nhiêu O thì chia đều và nối xung quanh hai nguyên tử chính, đảm bảo O có hóa trị II. b) Khi viết công thức của các hiđroxit, ta thực hiện các bước sau: Bước 1: Viết các nhóm H-O- song song (mỗi nguyên tử H tương ứng với 1 nhóm OH, trừ trường hợp H3PO3). Bước 2: Nối nguyên tử chính vào các nhóm -O-H đó. Bước 3: Còn bao nhiêu O thì nối xung quanh nguyên tử chính, đảm bảo O có hóa trị II. Công thức phân tử Công thức electron Công thức cấu tạo c) Khi viết công thức của các muối, ta thực hiện các bước sau: Bước 1: Viết công thức của các axit Bước 2: Có bao nhiêu gốc axit thì viết bấy nhiêu công thức của axit và sắp xếp song song nhau. Bước 3: Bỏ bớt nguyên tử H và thay bằng nguyên tử kim loại. Bài 3: Viết công thức cấu tạo của các phân tử sau: CuSO4, Fe3O4, Al2O3, Cl2O7, N2O5. Bài 4: Viết công thức cấu tạo của các phân tử sau: HNO3, PCl5, AlCl3, H2CrO4, Al2S3, Al(OH)3. Bài 5: Viết công thức cấu tạo và công thức electron của BF3 và NH3. Giải thích tại sao BF3 có thể kết hợp được với NH3. Hướng dẫn giải Trong phân tử BF3 nguyên tử B xung quanh mới có 6e, vẫn còn thiếu 2e mới đạt cấu hình 8e lớp ngoài cùng bền vững. Trong phân tử NH4, nguyên tử N có một cặp electron tự do chưa liên kết. Cặp electron tự do này sẽ tạo liên kết cho – nhận với nguyên tử B trong BF3 Bài 6: Viết công thức cấu tạo và công thức electron của CO2 và SO2. Giải thích tại sao SO2 có thể kết hợp với oxi tạo thành SO3 còn CO2 không có khả năng đó. Hướng dẫn giải: Trong phân tử SO2, nguyên tử S còn một cặp electron chưa liên kết, có khả năng tạo liên kết cho – nhận với một nguyên tử oxi (còn thiếu đúng 2e để đạt cấu hình 8e lớp ngoài cùng). Còn trong phân tử CO2, nguyên tử C không còn electron tự do và cũng đã đạt cấu hình 8e lớp ngoài cùng bền vững nên nó không có khả năng kết hợp với oxi được nữa.
